حبة لعلاج مرض فقر الدم المنجلي من خلال مركب ينشط الجين
حبة لعلاج مرض فقر الدم المنجلي من خلال مركب ينشط الجين
مصر:إيهاب محمد زايد
إن الإستراتيجية الدوائية، التي أظهرت أنها تنتج الهيموجلوبين في حيوانات المختبر، يمكن أن تنافس العلاجات الجينية المكلفة والمحفوفة بالمخاطر
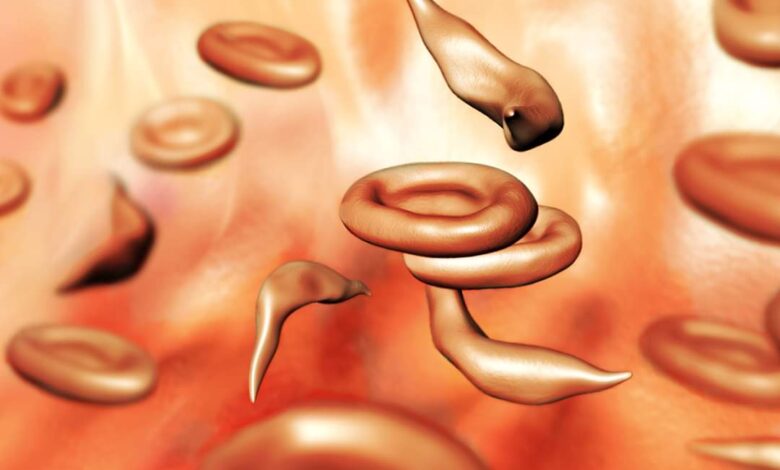
يقوم دواء تجريبي لمرض الخلايا المنجلية بتنشيط جين الهيموجلوبين الجنيني الذي يسمح لخلايا الدم الجديدة باتخاذ شكل طبيعي. سبنسر ساتون / مصدر العلوم
في العام الماضي، وافقت إدارة الغذاء والدواء الأمريكية (FDA) على إجراءين للعلاج الجيني يمكنهما علاج مرض فقر الدم المنجلي، وفي بعض الحالات علاجه بشكل أساسي،
وهو اضطراب دموي وراثي يسبب الألم وفقر الدم للملايين ولا يزال يقتل ما يقرب من 375000 شخص في جميع أنحاء العالم كل عام. سنة. لكن العلاجات الرائدة تتطلب علاجًا كيميائيًا محفوفًا بالمخاطر وتكلف حوالي 2 مليون دولار للشخص الواحد، مما يجعلها بعيدة عن متناول الغالبية العظمى من مرضى فقر الدم المنجلي. الآن، يقوم الباحثون الصيدلانيون بالإبلاغ عن دواء محتمل عن طريق الفم يعيد خلايا الدم السليمة في النماذج الحيوانية للمرض.
وعلى عكس العلاج الجيني لمرة واحدة والذي يمكن أن تستمر فوائده لعقود من الزمن، قد يتعين تناول المركب الجديد بشكل دوري مدى الحياة، ولم يبدأ بعد اختبار السلامة على البشر. لكن الدواء التجريبي، الذي تم وصفه اليوم في مجلة Science، يقدم الأمل في إمكانية علاج مرض فقر الدم المنجلي في يوم من الأيام على نطاق واسع وبتكلفة زهيدة باستخدام حبة بسيطة.
يقول لويس هسو، اختصاصي أمراض الدم لدى الأطفال في جامعة إلينوي بشيكاغو، والذي لم يشارك في البحث الجديد: “يبدو هذا واعدًا”. ومع ذلك، فهو يحذر من أن “هناك خطًا من العلاجات [الأدوية] لمرض فقر الدم المنجلي التي تنجح في الفئران والخلايا التي لم تنجح في البشر”.
ينجم مرض فقر الدم المنجلي عن طفرة في الجين المسؤول عن إنتاج الهيموجلوبين البالغ. يؤدي هذا التغيير إلى اتخاذ خلايا الدم الحمراء ذات الشكل القرصي الطبيعي شكل هلال مميز والالتصاق ببعضها البعض، مما يؤدي إلى انسداد الشعيرات الدموية وإتلاف الأنسجة وإثارة نوبات من الألم الشديد. يستخدم أحد العلاجين المعتمدين حديثًا فيروسًا مُصممًا هندسيًا لإدخال نسخ من نسخة معدلة من جين الهيموجلوبين البالغ في الخلايا الجذعية للمريض. ثم يتم إرجاع تلك الخلايا المبرمجة إلى الشخص بعد أن يزيل العلاج الكيميائي خلايا الدم الجذعية الموجودة.
يقوم العلاج الآخر المعتمد أيضًا بتعديل الخلايا الجذعية لدم المريض، ولكنه يستخدم نظام تحرير الجينات CRISPR لمنع جين بروتين يسمى BCL11A، والذي يثبط عند البالغين إنتاج شكل من أشكال الهيموجلوبين الذي تستخدمه الأجنة. أثناء مرحلة الرضاعة.
يتم تقليل كمية الهيموجلوبين الجنيني عادةً عندما يتحول الأطفال إلى إنتاج نسخة البالغين. لذلك، عندما يقوم كريسبر بإيقاف جين BCL11A، فإنه يستعيد إنتاج الهيموجلوبين الجنيني في الخلايا الجذعية في الدم، مما يساعد مرضى الخلايا المنجلية.
لكن التكلفة العالية والتعقيد الذي يتسم به العلاج الجيني جعل من الصعب رؤية كيف يمكن لأي من النهجين أن ينجح في البلدان ذات الدخل المنخفض، وخاصة تلك الموجودة في أفريقيا، حيث يقيم معظم الأشخاص المصابين بمرض فقر الدم المنجلي. يقول جاي برادنر، خبير الخلايا المنجلية في شركة الأدوية الحيوية أمجين: “للأسف، لن يصل هذا العلاج إلى العديد من المرضى”.
تبحث شركات الأدوية منذ فترة طويلة عن أدوية لتشغيل الهيموجلوبين الجنيني لدى البالغين. في عام 1998، وافقت إدارة الغذاء والدواء الأمريكية على دواء يسمى هيدروكسي يوريا، والذي وجد أنه يعزز إنتاج الهيموجلوبين الجنيني بشكل متواضع. لكن هذا الدواء يمكنه أيضًا تثبيط تكاثر الخلايا الجذعية لنخاع العظم، مما يسبب فقر الدم وآثارًا جانبية أخرى،
وهي المشكلة التي قلبت العديد من أدوية الخلايا المنجلية الأخرى رأسًا على عقب أيضًا. تقول باميلا تينج، الباحثة في أمراض الدم في شركة نوفارتس: “كان المجال بأكمله يعاني من هذا الأمر”.
قام فريق بقيادة تينج وبرادنر مؤخرًا بالبحث عن مركبات ترتبط ببروتين يسمى المخيخ، المعروف بتمييز البروتينات الأخرى لتدميرها بواسطة نظام إعادة تدوير البروتين الطبيعي للخلايا. كان الأمل الأصلي هو أن يتمكنوا من العثور على واحد يساعد المخيخ في وضع علامة على بروتين BCL11A،
وبالتالي استعادة إنتاج الهيموجلوبين الجنيني. قاموا بفحص مكتبة تضم 2814 جزيئًا مرتبطًا بالمخيخ، ثم قاموا بتغذية تلك الجزيئات بخلايا الدم الحمراء غير الناضجة، واكتشفوا جزيئًا يسمى dWIZ-1، يعمل على زيادة إنتاج الهيموجلوبين الجنيني.
لكنه لم يستهدف BCL11A بشكل غير متوقع، بل التصق ببروتين تنظيمي جيني آخر يسمى WIZ، والذي لم يكن معروفًا بتورطه في التحكم في مستويات الهيموجلوبين الجنيني. أدى المزيد من التحسين لهذا المركب إلى إنتاج dWIZ-2، والذي وجد الفريق أنه يزيد إنتاج الهيموجلوبين الجنيني في خلايا الدم الحمراء من خط الأساس بنسبة 17% إلى 45%.
ويقول برادنر إن الأخير عند مستوى يمكن أن ينتج خلايا دم حمراء وظيفية إذا تمت ترجمتها إلى البشر. أفاد الفريق أن المركب كان فعالًا أيضًا عند إعطائه عن طريق الفم للفئران وفي اثنين من كل ثلاثة قرود cynomolgus، وكل ذلك دون آثار جانبية واضحة. يقول برادنر: “هذا هو أول جزيء صغير يحفز الهيموجلوبين الجنيني دون الإضرار بالخلايا الجذعية”.
على الرغم من Tوبوعده، لا يزال المجمع يواجه التحديات. بالنسبة للمبتدئين، يتم تصنيع WIZ في العديد من أنواع الخلايا خارج خلايا الدم الحمراء ويبدو أن له دورًا في تنظيم نشاط العديد من الجينات. يقول ستيوارت أوركين، عالِم بيولوجيا الخلايا الجذعية في معهد دانا فاربر للسرطان بجامعة هارفارد، والباحث المخضرم في مجال الخلايا المنجلية، الذي لم يشارك في العمل الجديد: “قد يجعل ذلك عاملًا واسع النطاق للغاية” بحيث لا يمكن قمعه بأمان.
لكن برادنر يشير إلى أن dWIZ-2 يبدو أن له تأثيرًا كبيرًا في تعزيز الهيموجلوبين الجنيني. لذا، وبغض النظر عما إذا كان مركب نوفارتيس التجريبي قد نجح في التجارب السريرية، فقد ساعد بالفعل في الكشف عن طريقة جديدة للتحكم في أنواع خلايا الدم الحمراء الهيموجلوبين التي يتم إنتاجها. ويشير برادنر إلى أن هذا في حد ذاته يمكن أن يمهد الطريق لظهور أدوية محسنة لمرض فقر الدم المنجلي.